一、HCN溶液和NaCN溶液等体积,等物质的量混合,如何比较溶液中的HCN、Na+、CN-这三个粒子浓
由于CN-的水解程度远大于HCN的电离程度,所以HCN的浓度大于CN-的浓度,当然一定大于溶液物质的量浓度的1/2,则CN-浓度小于溶液浓度的1/2,Na+等于溶液物质的量浓度的1/2.于是有:c(HCN)>;
c(Na)>;
c(CN-)
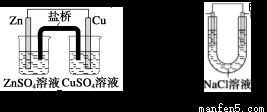
二、体积和物质的量怎么算得?详解~
银摩尔质量给一下

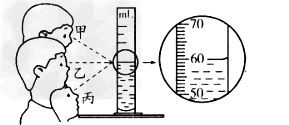
三、液态物质的体积可以用什么测量
液态物质的体积可以用量筒测量
四、如何比较物质的量浓度相等的溶液的凝固点?
比较溶液中实际存在的粒子的质量摩尔浓度。
氯化钾是完全电离的,所以实际上m=2 mol/kg。
醋酸部分电离,m=1~2mol/kg。
葡萄糖完全不电离,m=1 mol/kg。
所以,根据稀溶液的依数性。
氯化钾溶液凝固点最低,醋酸水溶液其次,葡萄糖水溶液最高。
(1)从实验表格的最后一列可以看出,水和酒精刚开始没有凝固,而当体积比达到一定值时,混合液可以凝固,但是并没有将水和酒精分离开,所以用张小同学的方案不能将水和酒精从混合液中分开。
(2)通常情况下水的凝固点是0℃,从表格的最后一列不难看出,在水中添加酒精后,凝固点低于0℃,所以添加酒精后会导致水的凝固点降低。
扩展资料:溶有杂质:如果液体中溶有少量其他物质,或称为杂质,即使数量很少,物质的熔点(凝固点,下同)也会有很大的变化。
例如水中溶有盐,熔点(固液两相共存并平衡的温度)就会明显下降,海水就是溶有盐的水,海水冬天结冰的温度比河水低,就是这个原因。
饱和食盐水的熔点可下降到约-22℃。
例题:为了分离酒精和水的混合物,张小同学依据已学过的知识,提出一种方案:依据水和酒精凝固点不同可将水和酒精分开。
参考资料来源:股票百科-凝固点

五、等物质的量浓度的盐酸和醋酸 等体积溶液与过量金属产生氢气的量谁更多 该怎么判断?
体积等物质的量浓度的盐酸和醋酸,生成氢气一样多,都是一元酸,所以能被反应掉的氢一样多,金属足量,里面酸的物质的量是一样多的
参考文档
声明:本文来自网络,不代表【股识吧】立场,转载请注明出处:https://www.gupiaozhishiba.com/store/65286434.html


