一、恒温恒压下,气体压强跟浓度成正比,物质的量与气体压强成正比,这句话对?
向着体积增大的方向移动。
恒温恒压下,通入惰性气体,会使容器中气体体积增大,,参与反应的气体物质的量不变,但是容器体积变大,势必导致压强变小,所以要向着体积增大的方向移动。
判断化学平衡移动主要用勒夏特列原理,其内容为:如果改变可逆反应的条件(如浓度、压强、温度等)改变条件对化学平衡的影响:浓度改变:增加某一反应物的浓度,则反应向着减少此反应物浓度的方向进行,即反应平衡向正反应方向移动进行。
减少某一生成物的浓度,则反应向着增加此生成物浓度的方向进行,即反应平衡向正反应方向移动进行。
反应速率及产率也会因为对外界因素系统的影响而改变。
温度改变:升高反应温度,则反应向着减少热量的方向进行,即放热反应逆向进行,吸热反应正向进行;
降低温度,则反应向着生成热量的方向的进行,即放热反应正向进行,吸热反应逆向进行。
压力改变:压力同样仍是朝消除改变平衡因素的方向进行反应。
增加某一气态反应物的压强,则反应向着减少此反应物压强的方向进行,即反应向正方向进行。
减少某一气态生成物的压强,则反应向着增加此生成物压强的方向进行,即反应向正方向进行。
反之亦然。
惰性气体(也叫稀有气体)的影响:影响压力的因素若是因为加了惰性气体(即稀有气体)如果生成物为气体,且反应前后体积变化,此时相当于减少了浓度,反应继续正向进行。
感觉这样的提问没有意义建议自己下去查查资料

二、化学等效平衡对于恒温恒压气体分子数可变的可逆反应为什么要物质的量与对应组分的起始加入量相同?
不对吧?对于恒温恒压下的可逆反应,只要加入的量和原比例相同就可以了(回归定比)对于恒温恒容气体分子数可变的可逆反应,要加入的量与对应组分的起始加入量相同(回归定值)对于恒温恒容气体分子数不变的可逆反应,只要加入的量和原比例相同就可以了(回归定比)
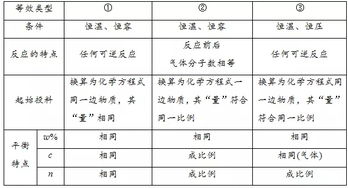
三、恒温恒压为什么只要投入物质的量浓度成比例的气体会达到等效平衡?
恒温恒压,转化率不会变,平衡常数也不会变,所以,是等效的啊

四、为什么在恒温恒压状态下,反应物或生成物的各组分物质的量比例相同,即为等效平衡。而在恒温恒容状态下,...
因为恒压的话,容器的体积可以改变。
如果反应后气体体积变为原来的n倍,由于容器体积等于气体体积,所以容器的体积也变为n倍,这样气体的浓度不变,即等效平衡;
而对于恒容,由于容器体积不变,如果反应前后气体体积变化的话,气体的浓度就会改变。
唯一的办法就是气体与原来完全一样,所以恒容只能是气体体积不变。

五、等效平衡恒温恒压为什么只需成比例,有恒温恒容时却要相等,还有,平衡常数与等效平衡有何关系
恒压的时候体积是会改变的.所以只要成比例.反应进行的程度就是相同的.就是有点像浓度是一样的.恒容的时候体积不变.物质的量什么的必须一样.浓度才一样........平衡常数越大反应进行的越容易....我是这样理解的.我也是上高二滴.有错误的话你通知我哈.希望能帮到你....

六、同温同压下,气态物质的量和它体积成正比,为什么啊?气体可以自由扩散的,容器体积就是气体体积,求解怎
气体体积是一个相对而言的,如果气体自身扩散,体积分数就减小至于你说的,他也会减小体积分数,要不然我拿一个地球大的容器,里面放一点氧气,难道能说有一瓶氧气嘛?

七、为什么在恒温、恒压下只要使各物质初始浓度对应成比例即可建立相似平衡。
等温等压下同一物质起始物质的量成比例 说明起始浓度相等 进而转化率相等 到平衡时各对应物质的物质的量浓度相等 所以两反应为等效平衡
参考文档
声明:本文来自网络,不代表【股识吧】立场,转载请注明出处:https://www.gupiaozhishiba.com/chapter/18390333.html



