一、比较等质量的烃完全燃烧耗氧量的大小,将烃的分子式CxHy化为CHy/x,y/x越大,耗氧量越大。这是为什么
烃的燃烧,碳原子与氧气结合的质量比为12:32,也就是3:8,氢原子与氧气结合的质量比为4:32,也就是1:8。
很明显,每一份质量的氢元素就能消耗掉8份质量的氧气,而每3份质量的碳元素才能消耗8份质量的氧气,氢的耗氧量更大。
烃分子CxHy中,y/x是氢原子个数与碳原子个数的比值,这个比值的大小能间接说明含氢质量分数的大小,y/x越大,含氢质量分数越高,耗氧量也就越大。
二、同质量的有机化合物,怎么比较消耗的氧气的多少
等摩尔的:看(x+y/4)的大小,他越大,耗氧量越多 CxHy+(x+y/4)O2=xCO2+(y/2)H2O等质量的:看x/y,他越大,耗氧量越小 一个C12g,耗氧32g;
一个H1g,耗氧8g 所以一个分子中,x/y越大,耗氧量越小
三、在物质的量和质量分别相等时,如何区分烃的耗氧量多少?
给你一个通式 CnHz耗氧量是n+z/2mol

四、同质量的烃,完全燃烧怎样比较耗氧量,与CO2与H2O?同物质的量呢?
看其中氢的质量分数,氢的质量分数越大,则消耗氧越多等物质的量时,看CxHy中的(X+Y/4)的相对大小

五、为什么相同质量的烃(CxHy) y/x越大 消耗的氧气越多
4gH消耗1mol氧气,而12g碳才消耗1mol氧气,所以氢的含量(质量分数)越大,耗氧量越多。
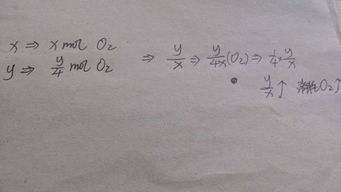
六、等质量的有机物充分燃烧消耗氧气大小怎么比较
比较含氢量4H---O2 C----O2 4g-----O2 12g------O2氢含量越大燃烧消耗氧气越多

参考文档
下载:相同质量的烃如何简易比较耗氧量.pdf《放量多久可以做主力的股票》《买股票买多久可以赎回》《股票合并后停牌多久》下载:相同质量的烃如何简易比较耗氧量.doc更多关于《相同质量的烃如何简易比较耗氧量》的文档...声明:本文来自网络,不代表【股识吧】立场,转载请注明出处:https://www.gupiaozhishiba.com/book/44593041.html



 窦尔顽
窦尔顽
发表于 2023-06-22 13:45回复 君若明:对于任意一种烃CxHy来说,他与耗氧量之间的关系为 1CxHy --- (x + y/4)O2 若是质量相等,设质量为1,先用1/M求出各种烃的物质的量,再乘以相应的(x+y/4),即得含氧量。如:质量相等的CH4,C2H4,C2H2,C10... [详细]
 吴越
吴越
发表于 2023-05-04 17:52回复 万通商联:CxHyOz +(x + y/4 -z/2)O2 = xCO2 + y/2 H2O\x0d\x0a物质的量相等的烃的含氧衍生物完全燃烧时耗氧量大小取决于(x + y/4 -z/2)值的大下,该值越大,耗氧量越多。
 武藤蓝
武藤蓝
发表于 2023-05-03 11:21回复 脚下天堂:等质量的烃完全燃烧消耗氧气的多少看烃中氢元素的质量分数,烃中氢元素的质量分数越高,消耗氧气的质量越多。具体过程如下:设烃的化学式为:CnHm,其燃烧的化学方程式为:CnHm+(n+m/4)O2→nCO2+m/2H2O 耗氧量的大小由n。
 爵士
爵士
发表于 2023-05-03 04:40回复 颜水成:你的问题是质量一定,含氢量多则含碳量相对就少,而烃燃烧中每2克氢耗16克氧,每6克碳(充分燃烧如生成CO2)耗氧是16克。所以等质量烃含氢量越大消耗氧气越多。